- ⌂
-
Le DPM
Les Equipements
L'Environnement
Zoom sur... Le Bâtiment André Rassat
Nommé d'après une figure tutélaire de la chimie grenobloise, ce bâtiment est recouvert d’une double peau en feuille métallique qui apporte une protection thermique sur 3 côtés et crée une unité architecturale favorisant l'intégration parmi les arbres du site.
-
Thématiques
Le Thème
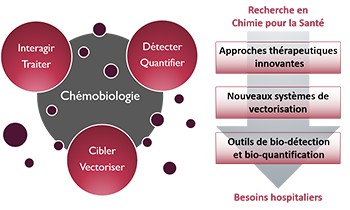
« Approches thérapeutiques innovantes »De nouvelles solutions thérapeutiques, de la cible biomacromolécu-laire émergente aux approches originales pour traiter les maladies
Le Thème
« Nouveaux systèmes de vectorisation »Combiner les propriétés d’inclusion de principes actifs, de franchisse-ment de barrières, d’adressage et de relar-gage en milieu vivant
Le Thème
« Outils de bio-détection et bio-quantification »Des dispositifs analytiques originaux pour la détection de cibles, de l’ion au micro-organisme en milieu complexe
Zoom sur... La Chémobiologie
-
Équipes
L'Équipe « COMET »
« COMET » développe la conception rationnelle, la synthèse et/ou l'extraction de composés à forte diversité/complexité comme nouveaux agents thérapeutiques et outils moléculaires pour la pénétration cellulaire ou la détection de biomolécules, actifs in vivo.L'Équipe « NOVA »
« NOVA » utilise des acides nucléiques fonctionnels comme éléments de reconnaissance pour des applications thérapeutiques ou diagnostiques, comme la sélection d'oligonucléotides, ou le développement de dispositifs d'analyses et de nanovecteurs.Les Services
-
Productions
Les Publications
La Vulgarisation
Les JSM
Zoom sur... La 12ème JSM (15 juin 2023)
Le DPM organise des journées scientifiques consacrées au médicament. L'objectif est de rassembler les spécialistes académiques et industriels autour d'une thématique. 2023 : Apports de la Chimie Click et de la Lumière en Chemobiologie
-
Partenariats
Les Formations
Les Consortiums
Les Financements
Zoom sur... L'environnement Grenoblois
Le DPM est un acteur central sur le bassin grenoblois en chimie, biologie et santé, lié au CHU Grenoble Alpes et à de nombreuses autres organisations : Pole de Recherche CBS, ICMG, Labex ARCANE, EUR CBH, Institut Carnot Polynat, Réseau GREEN.
Article
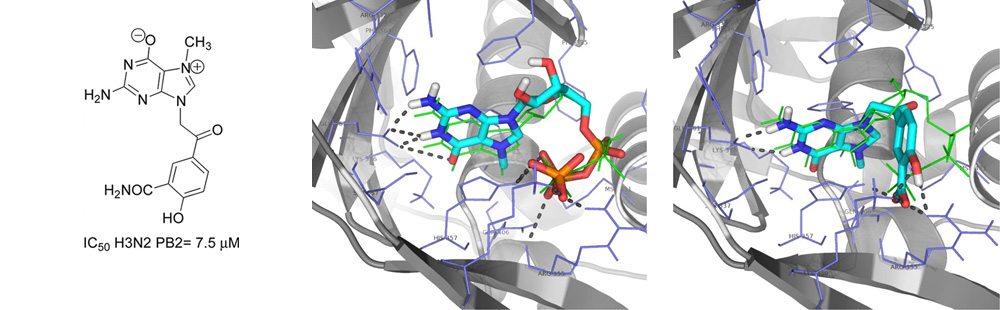
- Projet
- Antoine FORTUNE, Jean-Luc DECOUT,
- Titre
- New 7-methylguanine derivatives targeting the influenza PB2 cap-binding domain.
-
[Full paper
 ]
] - Auteurs
- S. Pautus, P. Sehr, J. Lewis, A. Fortuné, A. Wolkerstorfer, O. Szolar, D. Guilligay, T. Lunardi, J.-L. Decout, S. Cusack.
- Edition
- J. Med. Chem. 2013, 56, 8915-8930.
- Année
- 2013
- Résumé
- The heterotrimeric influenza virus polymerase performs replication and transcription of viral RNA in the nucleus of infected cells. Transcription by "cap-snatching" requires that host-cell pre-mRNAs are bound via their 5' cap to the PB2 subunit. Thus, the PB2 cap-binding site is potentially a good target for new antiviral drugs that will directly inhibit viral replication. Docking studies using the structure of the PB2 cap-binding domain suggested that 7-alkylguanine derivs. substituted at position N-9 and N-2 could be good candidates. Four series of 7,9-di- and 2,7,9-trialkyl guanine derivs. were synthesized and evaluated by an AlphaScreen assay in competition with a biotinylated cap analog. Three synthesized compds. (e.g., I) display potent in vitro activity with IC50 values lower than 10 μM. High-resoln. x-ray structures of three inhibitors in complex with the H5N1 PB2 cap-binding domain confirmed the binding mode and provide detailed information for further compd. optimization.




 Annuaire
Annuaire Contact
Contact Plan d'accès
Plan d'accès ENG
ENG Login
Login



