- ⌂
-
Le DPM
Les Equipements
L'Environnement
Zoom sur... Le Bâtiment André Rassat
Nommé d'après une figure tutélaire de la chimie grenobloise, ce bâtiment est recouvert d’une double peau en feuille métallique qui apporte une protection thermique sur 3 côtés et crée une unité architecturale favorisant l'intégration parmi les arbres du site.
-
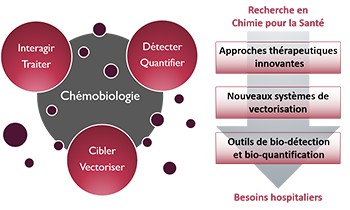
Thématiques
Le Thème
« Approches thérapeutiques innovantes »De nouvelles solutions thérapeutiques, de la cible biomacromolécu-laire émergente aux approches originales pour traiter les maladies
Le Thème
« Nouveaux systèmes de vectorisation »Combiner les propriétés d’inclusion de principes actifs, de franchisse-ment de barrières, d’adressage et de relar-gage en milieu vivant
Le Thème
« Outils de bio-détection et bio-quantification »Des dispositifs analytiques originaux pour la détection de cibles, de l’ion au micro-organisme en milieu complexe
Zoom sur... La Chémobiologie
-
Équipes
L'Équipe « COMET »
« COMET » développe la conception rationnelle, la synthèse et/ou l'extraction de composés à forte diversité/complexité comme nouveaux agents thérapeutiques et outils moléculaires pour la pénétration cellulaire ou la détection de biomolécules, actifs in vivo.L'Équipe « NOVA »
« NOVA » utilise des acides nucléiques fonctionnels comme éléments de reconnaissance pour des applications thérapeutiques ou diagnostiques, comme la sélection d'oligonucléotides, ou le développement de dispositifs d'analyses et de nanovecteurs.Les Services
-
Productions
Les Publications
La Vulgarisation
Les JSM
Zoom sur... La 12ème JSM (15 juin 2023)
Le DPM organise des journées scientifiques consacrées au médicament. L'objectif est de rassembler les spécialistes académiques et industriels autour d'une thématique. 2023 : Apports de la Chimie Click et de la Lumière en Chemobiologie
-
Partenariats
Les Formations
Les Consortiums
Les Financements
Zoom sur... L'environnement Grenoblois
Le DPM est un acteur central sur le bassin grenoblois en chimie, biologie et santé, lié au CHU Grenoble Alpes et à de nombreuses autres organisations : Pole de Recherche CBS, ICMG, Labex ARCANE, EUR CBH, Institut Carnot Polynat, Réseau GREEN.
Synthèse et extraction orientés vers la diversité et la complexité
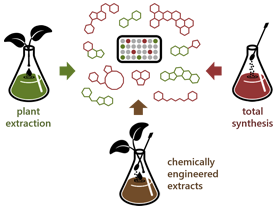
Le concept de synthèse orientée vers la diversité et la complexité est devenue un axe de recherche majeur, à la fois pour la conception de chimiothèques et pour le développement de molécules plus variées, couvrant des espaces chimiques inexplorés. Le projet se donne ainsi pour ambition de concevoir des structures complexes inspirées des produits naturels, de créer de la complexité et de la diversité à partir de molécules simples, et d'établir de nouvelles approches de synthèse. Trois stratégies principales sont mises en œuvre pour permettre la génération rapide de molécules complexes. En appui, une chimiothèque est constituée au laboratoire, rassemblant les molécules issues des projets de recherche, et de celui-ci en particulier.
La reproduction de la complexité des produits naturels est tout d'abord un défi constant et crucial en synthèse, étant donnée la variété des structures qu'ils adoptent et les activités biologiques qu'ils présentent. Nous nous proposons donc de développer de nouvelles approches pour le contrôle de la stéréochimie dans le cadre de la synthèse des produits naturels. Dans ce contexte, de nouvelles méthodes utilisant des cycloadditions asymétriques et la réactivité des amino-nitriles sont élaborées, avec en ligne de mire la production d'alcaloïdes bicycliques présentant des activités neurologiques (axe « Reproduction de la complexité des produits naturels »).
Ensuite, la possibilité de produire des intermédiaires réactifs à partir de matériaux simples, capables de générer des composés combinatoires énantiopurs aux structures complexes en une seule étape, est particulièrement recherchée. Des réactions « tandem » multicomposés et/ou en cascade sont donc développées. En particulier, l'utilisation de phénol comme point de départ pour des réactions en cascade, le développement d'approches organocatalysées énantiosélectives pour la production d'hétérocycles sans métaux, et la synthèse d'indolizines constituent d'importants sujets de recherche (axe « Génération de diversité/complexité à partir de composés simples »).
Enfin, les extraits naturels bruts peuvent être vus comme des chimiothèques naturelles contenant un grand nombre de molécules très variées, inconnues pour la plupart. L'approche métabolomique est aussi utilisée sur les plantes (Workflow4Metabolomcs et le logiciel Metgem). L'altération in situ d'extraits avec des méthodes de synthèse organique peut ainsi ouvrir une nouvelle voie vers une combinaison sans précédent des espaces chimiques naturel et synthétique, incluant une amélioration des propriété « drug-like » et/ou une incorporation de fragments d'intérêt pour une activité biologique donnée. L'utilisation du support solide constitue un outil crucial pour la modification et l'isolement des composés issues de ces extraits chimiquement altérés (axe « Combinaison des espaces chimiques naturel et synthétique »).
Benjamin BOUCHERLE, Philippe DELAIR, Marine PEUCHMAUR, Cécile VANHAVERBEKE, Yung-Sing WONG
Mots-clés : Produits naturels bioactifs, Synthèse totale, Extraction, Phytochimie, Médecine traditionnelle, Flavonoïdes, Alcaloïdes, Hétérocycles
Publications
-
Article • Purine Chemistry in the Early RNA World at the Origins of Life: From RNA and Nucleobases Lesions to Current Key Metabolic Routes [Full paper
 ]
] Decout, J.-L.; Maurel, M.-C.
ChemBioChem 2025, 26 (11), e202500035
-
Article • Drug Incompatibilities and Complex Assemblies: Let Us Remain Vigilant! [Full paper
 ]
] Salomez-Ihl, C.; Martin Mena, A.; Molina, M.-C.; Chapuis, R.; Durand, M.; Chanoine, S.; Leenhardt, J.; Py, P.; Brunet, M.-D.; Wong, Y.-S.; Chevallier, M.; Décaudin, B.; Odou, P.; Bedouch, P.; Mazet, R.
Pharmaceuticals 2025, 18 (5), 626
-
Article • Comparative metabolomics reveals how the severity of predation by the invasive insect Cydalima perspectalis modulates the metabolism re–orchestration of native Buxus sempervirens [Full paper
 ]
] A. E. Hay, C. Deborde, T. Dussarrat, A. Moing, A. Millery, T. P. T. Hoang, D. Touboul, M. Rey, L. Ledru, S. Ibanez, P. Pétriacq, C. Vanhaverbeke & C. Gallet
Plant Biology, 2024, ⟨10.1111/plb.13691⟩
-
Article • Expanding Chemical Frontiers: Approaches for Generating Diverse and Bioactive Natural Product-Like Compounds Libraries from Extracts [Full paper
 ]
] Aurélien Beato, Romain Haudecoeur, Benjamin Boucherle and Marine Peuchmaur
Chem. Eur. J. 2024, e202304166
-
Article • Investigation of Chemical Composition and Biological Activities of Ajuga pyramidalis—Isolation of Iridoids and Phenylethanoid Glycosides [Full paper
 ]
] A. Gori, B. Boucherle, A. Rey, M. Rome, C. Barette, E. Soleilhac, C. Philouze, M.-O. Fauvarque, N. Fuzzati, M. Peuchmaur
Metabolites 2023, 13, 128
-
Article • Pyrrolizidine-Derived Alkaloids: Highly Toxic Components in the Seeds of Crotalaria Cleomifolia Used in Popular Beverages in Madagascar [Full paper
 ]
] A. H. D. Solofomalala, C. F. Rajemiarimoelisoa, R. L. Judicael, H. R. Randrianarivo, D. A. D. Rakoto, V. L. Jeannoda, A. Boumendjel
Molecules 2021, 26, 3464
-
Article • Untargeted Metabolomics Approach to Discriminate Mistletoe Commercial Products [Full paper
 ]
] C. Vanhaverbeke, D. Touboul, N. Elie, M. Prévost, C. Meunier, S. Michelland, V. Cunin, et al
Sci. Rep. 2021, 11, 14205
-
Article • Development of an Innovative Maceration Technique to Optimize Extraction and Phase Partition of Natural Products [Full paper
 ]
] A. Gori, B. Boucherle, A. Rey, M. Rome, N. Fuzzati, M. Peuchmaur
Fitoterapia 2021, 148, 104798
-
Article • Does the Phytochemical Diversity of Wild Plants Like the Erythrophleum Genus Correlate with Geographical Origin? [Full paper
 ]
] C. Delporte, N. Noret, C. Vanhaverbeke, O. J. Hardy, J.-F. Martin, M. Tremblay-Franco, D. Touboul, A. Gorel, M. Faes, C. Stévigny, P. Van Antwerpen, F. Souard
Molecules 2021, 26, 1668
-
Article • Does phytochemical diversity of wild plants as Erythrophleum genus correlate with geographical origin? [Full paper
 ]
] Cédric Delporte *, Nausicaa Noret, Cécile Vanhaverbeke, Olivier J. Hardy, Jean-François Martin, Marie Tremblay-Franco, David Touboul, Anais Gorel, Marie Faes, Caroline Stévigny, Pierre Van Antwerpen, Florence Souard
Molecules 2021, 26(6), 1668
-
Article • Phytochemical and Biological Investigation of Helianthemum nummularium, a High-Altitude Growing Alpine Plant Overrepresented in Ungulates Diets [Full paper
 ]
] M Agostini, I Hininger-Favier‡, L Marcourt‡, B Boucherle‡, B Gao, B M Hybertson, S K Bose, J M McCord, A Millery, M Rome, E Ferreira Queiroz, J-L Wolfender , C Gallet, A Boumendjel
Planta Medica, 2020, 86, 1185-1190
-
Article • A One-Pot Synthesis of Highly Functionalized Purines [Full paper
 ]
] R. Zelli, W. Zeinyeh, R. Haudecoeur, J. Alliot, B. Boucherle, I. Callebaut, J.-L. Decout
Org. Lett. 19, 2017, 23, 6360-6363




 Annuaire
Annuaire Contact
Contact Plan d'accès
Plan d'accès ENG
ENG Login
Login




